發布時間:2019-05-28 瀏覽次數:584
腫瘤
2019年4月25日,中國科學家發表BTK抑制劑專利
2019年4月17日,BP-1003在胰腺導管腺癌的異種移植模型中顯示有效
2019年4月12日,武田發現新的低氧誘導因子脯氨酸羥化酶抑制劑
腫瘤免疫療法
2019年4月23日,PD-1與CTLA-4的不同之處
2019年4月4日,分泌雙特異性T細胞銜接器的CAR-T療法能夠克服膠質母細胞瘤的異質性
胃腸道疾病
2019年4月24日,武田公司發表ART-648用于治療NASH的臨床前研究數據
免疫調節劑
2019年4月10日,一款基于RNA的佐劑CV-8102與已上市狂犬疫苗聯用的I期臨床結果發布
感染
2019年4月24日,RO-7049389用于治療慢性HBV感染的I期臨床數據發布
代謝類疾病
2019年4月24日,帕金森藥物能夠抑制肥胖基因
神經系統疾病
2019年4月5日,二甲雙胍在阿爾茨海默癥模型中有積極作用
腫瘤
2019年4月25日,中國科學家發表BTK抑制劑專利
揚子江藥業和上海海雁醫藥科技有限公司發表了一類1,2-二氫吡咯[3,4-c]并吡啶/嘧啶-3-酮類化合物,作為酪氨酸蛋白激酶BTK抑制劑,有望用于治療癌癥、自身免疫性疾病、過敏和炎癥性疾病。
代表化合物I在LanthaScreenTR-FRET實驗中能夠抑制野生型BTK的活性(IC50=48 nM),并對野生型表皮生長因子受體(EGFR)具有選擇性(IC50> 10000 nM)。在HTRF實驗中,化合物I能夠抑制人B淋巴細胞癌Ramos細胞中的BTK在Tyr223位點上的磷酸化(IC50=4 nm)(詳見專利WO 2019062328)。
代表化合物II在TR-FRET實驗中顯示能夠抑制野生型BTK的活性(IC50=69 nM),且對野生型EGFR具有選擇性(IC50 >10000 nM)。在口服30 mg/kg劑量下,化合物在ICR小鼠體內的生物利用度為79.72%,半衰期為5.93 h(詳見專利WO 2019062329)。
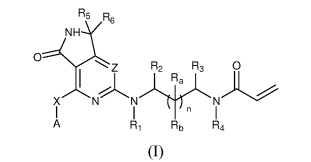
圖1 化合物I的結構
2019年4月17日,BP-1003在胰腺導管腺癌的異種移植模型中顯示有效
來自Bio-PathHoldings的研究人員發現了一種新的信號傳導及轉錄激活因子-3(STAT3)抑制劑,一個脂質體結合的反義寡核苷酸BP-1003,并研究了該化合物對非小細胞肺癌和白血病細胞的抑制作用。作為候選化合物的BP-1003能夠降低NSCLC細胞的生存能力,同時能降低白血病和淋巴瘤細胞的存活率,但不影響外周血單核細胞(PBMCs)的生存。體外活組織敏感性試驗表明,18例胰腺導管腺癌(PDAC)患者來源的異種移植(PDXs)模型中,有9例的組織切片存活率顯著降低了30%以上。在BP-1003單獨治療或聯合吉西他濱用于PDAC PDX小鼠模型治療的體內研究中,數據顯示BP-1003在體內降低了STAT3的表達,它與吉西他濱的聯合應用能使腫瘤縮小。這些臨床前結果提示,BP-1003作為單藥和聯合用藥都具有良好的體內活性,有望成為一種晚期和/或轉移腫瘤的治療新策略。目前已計劃對BP-1003進行申報IND的研究。
(Dai, B. et al. 110th AnnuMeet Am Assoc Cancer Res (AACR) (March 29-April 3, Atlanta) 2019, Abst 4786)
2019年4月12日,武田發現新的低氧誘導因子脯氨酸羥化酶抑制劑
武田制藥公司報道了一類N-(氰基取代芐基或吡啶甲基)-3-羥基吡啶酰胺類衍生物,作為缺氧誘導因子(HIF)脯氨酸羥化酶抑制劑,尤其是Egl9同源物1(EGLN1;PHD2)的抑制劑,有望用于治療癌癥,心血管、腎臟、肺部疾病和代謝、血液學、肝臟疾病以及皮膚病變等。代表化合物在細胞HIF-alpha穩定試驗中對PHD2酶的抑制活性為pIC50=8,對大鼠H9c2心肌細胞中PHD的抑制活性為pEC50=5.8(詳見專利WO 2019060850)。
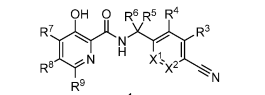
圖2 專利WO 2019060850中代表化合物的結構
腫瘤免疫療法
2019年4月23日,PD-1與CTLA-4的不同之處
檢查點分子程序性細胞死亡蛋白1(PD-1)在T細胞的整個生命周期中都有表達,但靶向PD-1和PD-L1并不能影響T細胞的活化,這與細胞毒性T淋巴細胞蛋白4(CTLA-4)檢查點阻斷劑有所不同。日本德島大學的研究人員證實,在T細胞活化階段,抗原呈遞細胞(APCs)上表達的PD-L1能夠與另一種APCs表達的表面分子CD80發生順式作用。這種順式作用在T細胞活化的早期破壞了PD-L1與PD-1的結合,從而抑制了T細胞的活性。作者寫道:“在沒有PD-L1與CD80順式作用的敲入小鼠中,PD-1能夠大大削弱腫瘤免疫和自身免疫反應。因此,靶向PD-L1/CD80順式作用的治療策略,可能為癌癥、自身免疫性疾病和慢性炎癥的治療提供新的思路”。
(Sugiura, D. et al.Science 2019, Advanced publication)
2019年4月4日,分泌雙特異性T細胞銜接器的CAR-T療法能夠克服膠質母細胞瘤的異質性
在2019年美國癌癥研究協會年會(AACR)上,麻省總醫院的研究人員提出了一種新的嵌合抗原受體T細胞(CAR-T)療法,用于治療表達野生型表皮生長因子受體(EGFR)的膠質母細胞瘤。在此之前,研究人員制備了一個定向于EGFRvIII的CAR-T細胞,這是在30%的多發性膠質母細胞瘤患者中發現的最常見變異。雖然該治療的安全性和耐受性良好,但殘余的腫瘤細胞仍然表達高水平的野生型EGFR。在進一步的研究中,科學家修飾了上述CAR-T細胞,使其分泌一種針對野生型EGFR的雙特異性T細胞銜接器(BiTE)。研究表明,由CAR-T細胞分泌的BiTEs可以與適當的抗原結合,在體外對EGFRvIII陰性腫瘤細胞和PDX神經球模型均具有抑制作用。此外,分泌的BiTEs會重新使旁觀者T細胞和CAR-BiTE細胞對EGFRvIII陰性腫瘤細胞進行攻擊。該療法對EGFRvIII陰性腫瘤的小鼠模型也安全、有效。上述結果證實,對EGFRvIIICAR-T細胞的修飾可能有助于克服多形性膠質母細胞瘤的異質性,值得在患者中進行進一步研究。
(Choi,B.D. et al. 110th Annu Meet Am Assoc Cancer Res (AACR) (March 29-April 3,Atlanta) 2019, Abst LB-066)
內容來源:摘自科睿唯安藥物新聞Bioworld Science。